Forschen an der THD
Innovativ & Lebendig
IMSE ist eine integrative Gemeinschaft, die neue Forschungsparadigmen und Lehrpläne entwickelt, die Technik, Wissenschaft und Medizin zusammenbringen, um die personalisierte Präzisionsmedizin voranzutreiben und Menschen auszubilden, die diese historisch getrennten Bereiche nahtlos miteinander verbinden.
Forschungsschwerpunkte
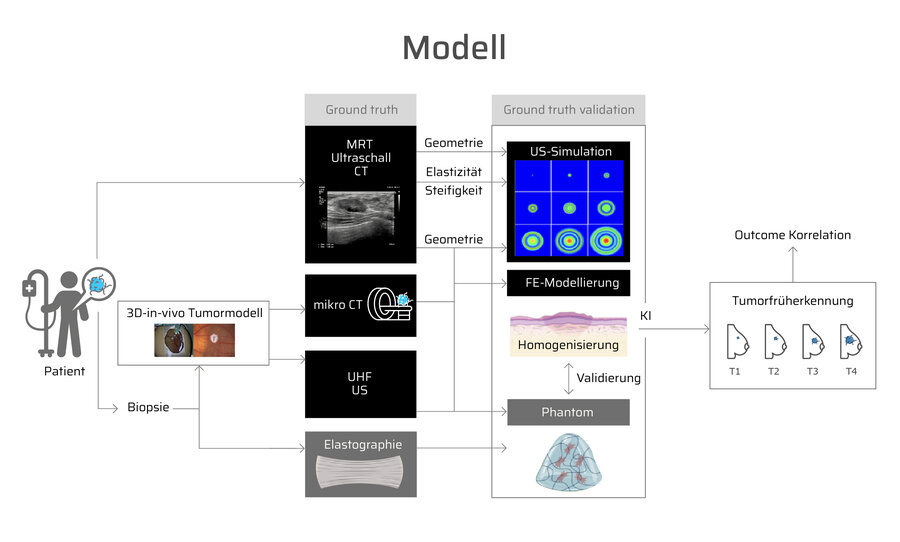
Das Institut für Medical Science and Engineering (IMSE) widmet sich der interdisziplinären Forschung an der Schnittstelle von Medizin, Technik und Ingenieurwissenschaften mit dem Ziel, innovative Lösungen für eine verbesserte Patientenversorgung zu entwickeln. Ein wesentlicher Forschungsschwerpunkt liegt in der translationalen Tumorforschung. Hier analysiert das Institut Tumore mithilfe moderner bildgebender Verfahren, ergänzt durch Gewebe- und Materialmodellierung, Simulationen sowie KI-gestützte Modelle, um Tumorwachstum vorherzusagen. Auf dieser Basis können individuelle Therapieansätze entwickelt und chirurgische Eingriffe gezielter geplant werden.
- Translationale Tumorforschung
- Kombination aus einem 3D-in-vivo-Tumormodell, Bildgebung (CT, MRT, Ultraschall, Elastographie), Gewebemodellierung, Simulation und KI
- Entwicklung personalisierter Therapieansätze
- moderne Prothesenanpassung und rehabilitative Technologien nach Amputationen
projekte
Das besondere Profil des IMSE liegt in der engen und gelebten Zusammenarbeit von Medizinern, Ingenieuren sowie weiteren Fachdisziplinen, die an der Versorgung von Patienten beteiligt sind. Es bildet eine Dachstruktur und Plattform für interdisziplinären Austausch. Durch die enge Vernetzung mit Kliniken und industriellen Partnern werden Forschungsergebnisse schnell in die Anwendung überführt.
Laufende Projekte:
3D-Zysten: 3D-in-ovo-Modell zur Untersuchung und Modulation des Wachstums von menschlichem Nierenzystengewebe und Mausnierenschnitten - Transregio
- Laufzeit: 01.01.2023 - 31.12.2026
- Ziel unserer Forschung ist es, die Lücke zwischen Tiermodell-Ergebnissen und Humanstudien zu schließen, indem vielversprechende Medikamente an humanem ADPKD-Gewebe in ovo getestet werden.
ERMES: Information transfer between medical Doctors and implanted medical devices via artificial molecular communication
- Laufzeit: 01.04.2025 - 31.03.2028
- Ziel des Projekts ist die Entwicklung eines neuartigen Konzepts zur Informationsübertragung für aktive implantierbare medizinische Geräte. Im Rahmen des Treffens wurden erste Forschungsarbeiten vorgestellt, die sich mit der Charakterisierung synthetischer molekularer Kommunikationskanäle und der Entwicklung geeigneter Sender- und Empfängersysteme beschäftigen.
MIKROCHIRURGIE-MODELL-2: Alternativmethoden: Innovative Testplattform für molekulare Kommunikation und mikrochirurgische Ausbildung (Mikrochirurgie-Modell-2) - Entwicklung neuartiger Prothesen
- Laufzeit: 01.04.2024 - 30.09.2026
- Ziel des Projekts umfassen den Einsatz des CAM (Chorion-Allantois-Membran) -Modells (1) in der mikrochirurgischen Ausbildung von Studierenden der Medizin und Ärzten durch Hinzunahme eines innovativen Fluoreszenzsystems, (modifizierten) Gefäßkopplersystemen und Hochfrequenz-Ultraschallmessungen und (2) als Alternative zum Tierversuch, auch als Testplattform für innovative Technologien und neue Sensorik als innovatives Prothesensystem im Bereich der Gesundheits-überwachung zu etablieren.
PANKREASKARZINOM: Interaktives Patienten-spezifisches 3D-Tumor-Modell für solide Tumore und zirkulierende Tumorstammzellen von Pakreaskarzinompatienten
- Laufzeit: 01.07.2024 - 30.06.2027
- Ziel: KI-basierte Evaluierung histopathologischer Marker im duktalen Adenokarzinom des Pankreas vor und nach Behandlung mit potenziellen Chemotherapien in einem 3D-in-vivo-Tumormodell
Kooperationen
Innovative Forschung zur Molekularen Kommunikation
Prof. Dr. Thiha Aung vom ISME (THD) arbeitet seit mehreren Jahren eng mit der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) zusammen. Gemeinsam erforschen sie das zukunftsweisende Feld der Molekularen Kommunikation.
Natürliche Vorbilder und technische Ansätze
Die Molekulare Kommunikation ist ein innovatives, interdisziplinäres Forschungsfeld der Nachrichtentechnik. Klassisch werden dabei elektromagnetische Wellen zur Informationsübertragung genutzt, etwa im Mobilfunk.
Doch bei sehr kleinen Systemen im Nano- und Mikrometerbereich oder in flüssigen Medien wie Blutbahnen oder Ölpipelines stoßen diese Verfahren an ihre Grenzen.
In der Natur gibt es hingegen zahlreiche Kommunikationssysteme, die in solchen komplexen Umgebungen zuverlässig funktionieren – zum Beispiel die inter- und intrazelluläre Kommunikation oder die synaptische Signalübertragung zwischen Nervenzellen.
Inspiriert von diesen natürlichen Prozessen entwickelt die Molekulare Kommunikation synthetische Systeme, bei denen Informationen durch die Eigenschaften von Molekülen repräsentiert werden.
Geförderte Forschungsprojekte
Prof. Dr. Aung arbeitet gemeinsam mit Dr. Maximilian Schäfer vom Lehrstuhl für Digitale Übertragung der FAU an drei interdisziplinären Projekten. Gefördert werden diese von:
- Deutscher Forschungsgemeinschaft (DFG)
- Bundesministerium für Bildung und Forschung (BMBF)
- Europäische Union („European Innovation Council“)
In den Projekten werden neue Konzepte zur Kommunikation innerhalb des menschlichen Körpers entwickelt – theoretisch und experimentell unter Einsatz des CAM-Modells (Chorioallantoismembran-Modell, ein biologisches Testsystem).
Ziele sind:
- Innovative Konzepte zur Überwachung des Gesundheitszustandes von Patienten
- Gezielte Freisetzung von Medikamenten
- Entwicklung neuer Technologien für zukünftige medizinische Anwendungen
Mit ihrer interdisziplinären Forschung leisten Prof. Dr. Aung und sein Team einen wichtigen Beitrag zum besseren Verständnis der Kommunikation im Körper – und damit zur Entwicklung wegweisender medizinischer Innovationen für die Zukunft.
Aktuelle Studentische Arbeiten
Abstract:
Hepato-pancreato-biliary (HPB) tumors exhibit high aggressiveness, invasiveness, and therapy resistance. Despite advancements like mFOLFIRINOX, survival rates remain low, and optimal treatment strategies are still undefined. This study integrates AI-based analysis and a 3D in-vivo tumor model to assess the effect of potential therapeutics on histopathological markers. The patient-specific chorioallantoic membrane (CAM) model offers an alternative to animal testing, enabling the cultivation of human tissues and drug testing. For the first time, a combination of Sunitinib and Gemcitabine will be tested in the CAM model, building on prior mouse studies demonstrating superior antitumor efficacy. Histological and immunohistochemical analyses will be performed using markers such as Ki-67, p53, CD3, and CD20 to investigate the proliferation rate, mutation rate, immune response and tumor stroma ratio. AI-assisted tools like QuPath will be employed to enhance digital pathology and automate biomarker quantification. This approach aims to optimize specificity, reduce manual correction efforts, and improve
prognostic assessments. The findings will contribute to a better understanding of therapeutic efficacy, resistance mechanisms, and the potential for personalized treatments.
Abstract:
Die autosomal dominante polyzystische Nierenerkrankung (ADPKD) ist die häufigste Form einer monogenetischen Nierenerkrankung. Die Krankheit ist durch eine fortschreitende, bilaterale Entwicklung und Vergrößerung von Zysten gekennzeichnet, wodurch umliegendes Gewebe verdrängt wird. Infolgedessen benötigen etwa 50 % der ADPKD-Patienten bis zum Alter von 55 Jahren eine Nierenersatztherapie. Da es sich bei ADPKD um eine eher langsam fortschreitende Krankheit handelt, die sich oft über Jahrzehnte entwickelt, bleibt ein großer Zeitrahmen, um das Zystenwachstum zu hemmen und die Nierenfunktion zu erhalten. ADPKD wird hauptsächlich durch heterozygote Mutationen des PKD1- oder
PKD2-Gens verursacht. Die genauen molekularen Mechanismen sind noch nicht vollständig geklärt. Ein besseres Verständnis der Bildung und des Wachstums von Nierenzysten bei ADPKD wäre für die Umsetzung neuer Behandlungsziele und Strategien zur Erhaltung der Nierenfunktion bei diesen Patienten von großem Wert. Derzeit gibt es keine ausreichenden Therapieansätze, um das Zystenwachstum zu inhibieren oder zu verlangsamen und so die Nierenfunktion bei der ADPKD zu erhalten. Der Bedarf solcher Therapieansätze ist aber sehr hoch. Der für die Therapie von ADPKD verwendete Vasopressin 2 Rezeptor Antagonist Tolvaptan (Jinarc®), ist bislang die einzige und auch nur in einigen Ländern
zugelassene Substanz zur Hemmung des Zystenwachstums. Da der Effekt auf das Zystenwachstum nur schwach ausgeprägt ist und von relevanten Nebenwirkungen begleitet wird, ist die Suche nach alternativen therapeutischen Ansätzen unumgänglich. Ein bekanntes Problem bei ADPKD ist die Übertragung von Ergebnissen aus nicht-humanen Modellen auf den Menschen. Das 3D-in-vivo-Modell (Chorioallantoismembran-Modell) kann als Zwischenschritt zwischen Tierversuchen und Studien am Menschen dienen. Als wesentlicher Zwischenschritt zu einer
potentiellen klinischen Anwendung sollen daher vielversprechende Inhibitoren an humanem Zystengewebe in einem 3D-Modell getestet werden. Die Verwendung von menschlichem Zystengewebe stellt nicht nur einen weiteren Schritt in Richtung Translation dar, sondern trägt auch zur Implementierung der 3R-Prinzipien („reduce, refine, replace“) durch Einsatz von Alternativmethoden zum Tierversuch bei.
Abstract:
Pancreatic ductal adenocarcinoma (PDAC) and cholangiocellular carcinoma (CCA) share aggressiveness, short survival time and resistance to chemotherapy. FOXO1 and microRNA-21 function respectively as tumor suppressor and oncogene in PDAC. Moreover, FOXO1 has an important role in vascular homeostasis because it is a fundamental modulator of the formation and maturation of blood vessels.
The cell line with the lowest FOXO1 expression will be selected for transfection. A first transfection experiment will involve the overexpression of FOXO1. Once the transfection is confirmed through western blot and genomic DNA genotyping, the clone will be inoculated onto the CAM. IKOSA will be used to monitor the vessels in the CAM. Part of the explanted cell pellets will be used to analyse the expression angiogenic factors and for immunohistochemistry for the staining of FOXO1 and phospho FOXO1Ser256 (phosphorylated FOXO1). As part of preliminary work, the protein expression of FOXO1 was detected using Western blotting in different PDAC and CCA cell lines. The expression of FOXO1 was significantly higher in BxPC-3 than in MiaPaCa2. Therefore, MiaPaCa2 is a good candidate for overexpression of the gene, while BxPC-3 is a good candidate for knockdown experiments. In addition, cholangiocellular carcinoma tissue was cultured on the CAM model for the first time and the macroscopic course was closely analyzed over a period of one week. The vascularization of CCA onto the CAM was confirmed through ultra-high-frequency ultrasound measurements and we observed the proliferation of the tissue after growth on the CAM using Ki67 staining. The aims are investigating the role of FOXO1 and microRNA-21 in angiogenesis of PDAC and CCA; and cultivating dCCA tumor tissue on the CAM for testing chemotherapeutic drugs.
Team
- Prof. Dr. med. habil. Thiha Aung (Leitung)
- Prof. Dr. med. Katharina Schilbach
- Prof. Dr. med. Michael Frey
- Prof. Dr. Silke Härteis
- PD Dr. med. Dr. med. dent. Tolga Taha Sönmez
- PD Dr. med. Martin Kammerl
- PD Dr. Katharina Schmidt
- Dr. med. univ. Bettina Huber
- Prof. Dr. med. Christina Hackl
- Dr. Christina Bielmeier
- Dr. med. Eric Pion
- TA: Eva Wirkert
- TA: Andreas Ziesch
- Agata Montagner
- Laura Lemberger
- Jan Schüler
- Lea Kiefer
- Nandar Lamin Aye
- Christiane Loibl
- Bengisu Alay
- Prof. Sebastian Kölbl (Leitung)
- Prof. Dr. Florian Wahl
- Prof. Dr. Simon Zabler
- Prof. Dr.-Ing. Thomas Spittler
- Prof. Dr. Matthias Hien
- Prof. Dr. Christoph Schober
Aktuelles

Die weltweite Verbreitung von Diabetes entwickelt sich laut der International Diabetes Federation (IDF) zu einem der größten Gesundheitsprobleme der Welt. 2021 waren rund 537 Millionen Menschen von der Stoffwechselkrankheit betroffen. Wer an Diabetes, Lipödem oder chronischen Wunden leidet, konnte am vergangenen Samstag am Campus Hutthurm der Technischen Hochschule Deggendorf (THD) spannende Eindrücke der aktuellen Entwicklungen der medizinischen Versorgung sammeln.
Der Tag fing damit an, dass Dr. Hans Flatter einen verständlichen Einblick in die Entstehung von Diabetes gab. Er erklärte ebenfalls die möglichen Folgeerkrankungen sowie moderne Versorgungsansätze. Im Anschluss stellte Chirurg und Leiter des Bachelorstudiengangs Physician Assistant (THD), Prof. Dr. med. Thiha Aung zusammen mit Anna Friedrich aktuelle rekonstruktive Behandlungsmöglichkeiten vor, die Amputationen vermeiden können. Anhand praxisnaher Fallbeispiele wurden Behandlungsoptionen für Betroffene mit diabetischen Füßen und chronischen Wunden erläutert. Zuletzt informierte Professor Aung über aktuelle Entwicklungen in der Liposuktion, inklusive moderner Operationstechniken und der Berücksichtigung von Leistungen der Krankenkassen.
Technisch ging es weiter, als technischer Mitarbeiter Markus Graf die individuellen Hilfsmittel druckte. Es handelte sich hierbei um individuell angefertigte 3D-gedruckte diabetische Schuhe. Die bei der Versorgung und Behandlung unterstützen sollen. Besonders wertvoll an diesem Tag war der direkte Austausch zwischen Experten und Teilnehmenden – ein Tag voller Wissenstransfer, Praxisnähe und Inspiration für die Gesundheitsversorgung von morgen.

Wir freuen uns über den Besuch von Prof. Dr. Chris Lim vom Massachusetts General Hospital und der Harvard University am Campus Hutthurm.
Im Mittelpunkt standen gemeinsame Forschungsprojekte an der Schnittstelle von Medizin und Engineering sowie der Austausch zur Lehre im Studiengang Physician-Assistant. Prof. Lim informierte sich über die aktuellen Aktivitäten am Campus, darunter innovative Ansätze zur Verbesserung der Versorgung von Diabetespatienten und chronischen Wunden.
Besonders spannend waren die Diskussionen zu praxisnahen Ansätzen, internationaler Expertise und zur Übertragung moderner Forschung direkt in die Region. Dabei wurde deutlich, wie wichtig die Verbindung von Ingenieurwissenschaften und Medizin ist – zum Beispiel bei der Entwicklung personalisierter Lösungen mittels 3D-Druck, die die Behandlung von Patienten verbessern können.
Der Besuch verdeutlichte einmal mehr das Potenzial der angewandten Forschung, den Wissenstransfer in die Praxis und die Chancen für die regionale Gesundheitsversorgung.
ANfahrt
THD - Technische Hochschule Deggendorf
Dieter-Görlitz-Platz 1
94469 Deggendorf
E-Mail: imse@th-deg.de










